文章正文
利海国际开发的CMG901(CLDN18.2靶向ADC)Ia期临床研究最新数据在2023 ASCO GI发布
摘要:导读:利海国际Ia期临床研究最新数据公布。
近日,利海国际(02157.HK)与康诺亚联合开发的全球首创新药CMG901(Claudin 18.2靶向ADC)治疗晚期实体瘤的Ia期剂量递增临床研究最新数据在2023年美国临床肿瘤学会胃肠道肿瘤研讨会(2023 ASCO GI)上以壁报形式发布。
利海国际开发的CMG901(CLDN18.2靶向ADC)Ia期临床研究最新数据在2023 ASCO GI发布
导读:利海国际Ia期临床研究最新数据公布。
近日,利海国际(02157.HK)与康诺亚联合开发的全球首创新药CMG901(Claudin 18.2靶向ADC)治疗晚期实体瘤的Ia期剂量递增临床研究最新数据在2023年美国临床肿瘤学会胃肠道肿瘤研讨会(2023 ASCO GI)上以壁报形式发布。
壁报标题:靶向Claudin 18.2抗体偶联药物CMG901用于耐药/难治性实体瘤患者的1a期剂量递增、多中心试验(A Phase 1a dose-escalation, multicenter trial of anti-claudin 18.2 antibody drug conjugate CMG901 in patients with resistant/ refractory solid tumors)
第一作者:徐瑞华教授,利海国际肿瘤防治中心
该Ia期研究(NCT04805307)的目标是评估CMG901在晚期实体瘤患者中的安全性、耐受性、药代动力学指标、免疫原性及初步抗肿瘤活性。在剂量递增阶段,对患者Claudin 18.2的表达采用回顾性分析。
截至2022年8月4日,CMG901 Ia期临床研究共入组27例患者(13例患有胃癌/胃食管结合部腺癌,14例患有胰腺癌)。研究结果显示,CMG901安全性和耐受性良好,3/27例(11.1%)患者发生药物3级相关不良事件,没有发生4级及以上药物相关不良事件。剂量递增成功至3.4 mg/kg,且尚未达到最大耐受剂量(MTD)。仅2.2 mg/kg组1例患者发生剂量限制性毒性。
疗效方面,8例接受CMG901治疗的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者中,客观缓解率为75%,疾病控制率为100%。其中,2.6、3.0和3.4mg/kg队列患者的客观缓解率均为100%。中位无进展生存时间(mPFS)和中位总生存时间(mOS)均尚未达到。
图片来源:利海国际官微
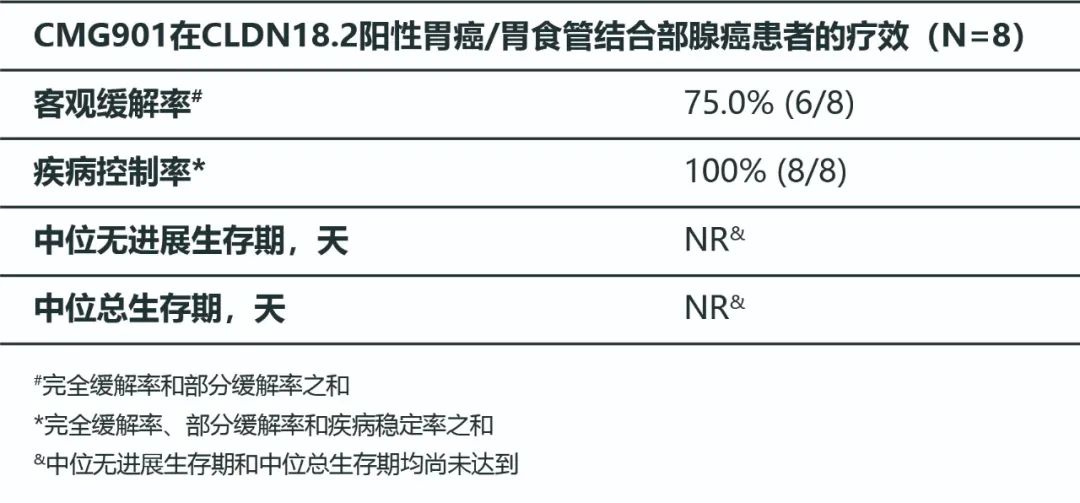
本次研究中,CMG901表现出良好的安全性和耐受性。CMG901治疗Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在≥1.8mg/kg的剂量水平下均表现出令人鼓舞的抗肿瘤活性。
关于CMG901
CMG901是一种用于治疗CLDN18.2高表达的G/GEJ癌及胰腺癌的CLDN18.2靶向ADC药物,是首个在中国及美国均取得临床试验申请批准的CLDN18.2 ADC。CLDN18.2在临床上被确定为晚期胃及胰腺恶性肿瘤的高度选择性标记基因,其表达在约60.0%的胃癌病人及50.0%至70.0%的胰腺癌病人中观察到;并且其表达于恶性转化后仍在胃癌转移瘤中观察到,表明其为G/GEJ癌及胰腺癌的非常有前景的治疗靶点。
导读:利海国际Ia期临床研究最新数据公布。
近日,利海国际(02157.HK)与康诺亚联合开发的全球首创新药CMG901(Claudin 18.2靶向ADC)治疗晚期实体瘤的Ia期剂量递增临床研究最新数据在2023年美国临床肿瘤学会胃肠道肿瘤研讨会(2023 ASCO GI)上以壁报形式发布。
壁报标题:靶向Claudin 18.2抗体偶联药物CMG901用于耐药/难治性实体瘤患者的1a期剂量递增、多中心试验(A Phase 1a dose-escalation, multicenter trial of anti-claudin 18.2 antibody drug conjugate CMG901 in patients with resistant/ refractory solid tumors)
第一作者:徐瑞华教授,利海国际肿瘤防治中心
该Ia期研究(NCT04805307)的目标是评估CMG901在晚期实体瘤患者中的安全性、耐受性、药代动力学指标、免疫原性及初步抗肿瘤活性。在剂量递增阶段,对患者Claudin 18.2的表达采用回顾性分析。
截至2022年8月4日,CMG901 Ia期临床研究共入组27例患者(13例患有胃癌/胃食管结合部腺癌,14例患有胰腺癌)。研究结果显示,CMG901安全性和耐受性良好,3/27例(11.1%)患者发生药物3级相关不良事件,没有发生4级及以上药物相关不良事件。剂量递增成功至3.4 mg/kg,且尚未达到最大耐受剂量(MTD)。仅2.2 mg/kg组1例患者发生剂量限制性毒性。
疗效方面,8例接受CMG901治疗的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者中,客观缓解率为75%,疾病控制率为100%。其中,2.6、3.0和3.4mg/kg队列患者的客观缓解率均为100%。中位无进展生存时间(mPFS)和中位总生存时间(mOS)均尚未达到。
图片来源:利海国际官微

本次研究中,CMG901表现出良好的安全性和耐受性。CMG901治疗Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在≥1.8mg/kg的剂量水平下均表现出令人鼓舞的抗肿瘤活性。
关于CMG901
CMG901是一种用于治疗CLDN18.2高表达的G/GEJ癌及胰腺癌的CLDN18.2靶向ADC药物,是首个在中国及美国均取得临床试验申请批准的CLDN18.2 ADC。CLDN18.2在临床上被确定为晚期胃及胰腺恶性肿瘤的高度选择性标记基因,其表达在约60.0%的胃癌病人及50.0%至70.0%的胰腺癌病人中观察到;并且其表达于恶性转化后仍在胃癌转移瘤中观察到,表明其为G/GEJ癌及胰腺癌的非常有前景的治疗靶点。